过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。已知:温度过高过氧化钙会分解生成氧化物和氧气。
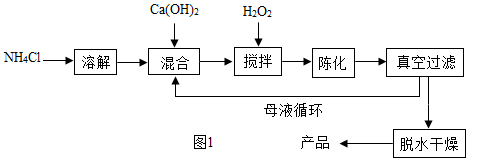
方法1:由Ca(OH)2为原料最终制得,其制备流程如下:
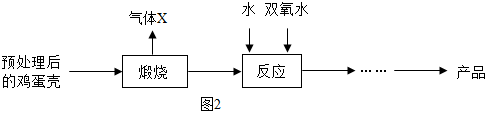
方法2:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
(1)方法1中搅拌的目的是 。请将搅拌过程中发生反应的化学方程式补充完整:
CaCl2 + H2O2 + 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl。制备过程中除水外可循环使用的物质是 (填化学式);
(2)方法2中气体X是 ,实验室常用 溶液来吸收。煅烧后的反应时化合反应,也能生成CaO2·8H2O,反应的化学方程式为 。该反应需控制温度在0 ~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式);
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 ;
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。
相同质量的M、N两种活泼金属,分别与足量的同种浓度稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如右图所示。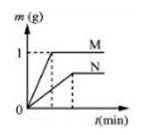
(1)金属活动顺序是M比N(填“强”或“弱”),相对原子质量是M比N的(填“大”或“小”)。
(2)M与稀盐酸反应结束后,消耗稀盐酸中HCl的质量为g。
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。
(1)按人类开始使用这三种金属的先后排序为(用元素符号表示)。
(2)在空气中铝制品更耐腐蚀的原因是。
(3)只用一种试剂即可验证这三种金属的活动性顺序,下列试剂中能达到目的的是(填序号)。
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
(4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度(填“大”或“小”)。
某学生把少量的生铁放入烧杯中并注入足量的稀硫酸中,能观察到的现象有:
①生铁表面有产生,②溶液逐渐变为,③完全反应后烧杯底部有黑色残渣,其化学式为。以上反应的化学方程式为。
盛放在油罐车内的石油产品在振荡时产生静电,容易引起火灾甚至爆炸事故,若在油罐车尾部挂一条拖地的铁链便可以防止事故的发生,这是利用铁___________的性质。
请根据下列实验装置图回答有关问题: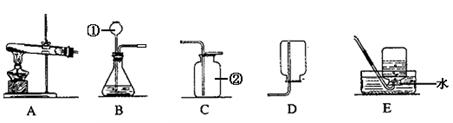
(1)请写出图中仪器的名称:①,②。
(2)实验室里常用大理石和稀盐酸反应制取二氧化碳,化学方程式是,可选用的发生装置和收集装置是(选填字母),检验该发生装置气密性的方法是
。
(3)若用A作为氧气的发生装置,化学方程式是。
(4)实验室里常用锌粒和稀硫酸反应制取氢气,现发生装置选择下图F,收集装置选择下图G。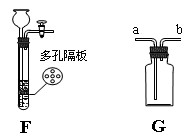
①选用F作为氢气发生装置的优点是。
②G装置若用于排空气法收集氢气,氢气应从端(选填“a”或“b”,下同)通入;若用于排水法收集氢气时,瓶中先装满水,氢气应从端通入。