在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
下列对化学反应的认识错误的是
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: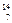 N+
N+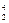 He→
He→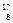 O+
O+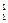 H,下列叙述正确的是
H,下列叙述正确的是
A.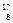 O原子核内有9个质子 O原子核内有9个质子 |
B.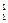 H原子核内有1个中子 H原子核内有1个中子 |
C.O2和O3互为同位素 |
D.通常情况下,He和N2化学性质都很稳定 |
25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1∶100混合,反应后所得溶液pH=7。若x=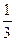 y,则x值为
y,则x值为
| A.2 | B.3 | C.4 | D.5 |
在指定环境下,下列各组离子可以大量共存的是
| A.在无色透明溶液中:Al3+、Na+、HCO3-、Cl- |
| B.在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I- |
| C.加入铝粉放出氢气的溶液: K+、Ca2+、NO3-、SO42- |
| D.在水电离产生的H+的浓度为1×10-13mol・L-1的溶液:Cu2+、Na+、NO2-、SO42- |
反应N2O4(g) 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是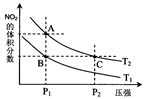
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C