下列离子方程式正确的是
| A.向NaHCO3溶液中加入少量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
| B.FeCl3溶液与Cu的反应:Cu+ Fe3+="=" Cu2++ Fe2+ |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2 H+="=" Ca2++H2O+CO2↑ |
| D.氯化铝溶液中加入过量氨水:Al3++ 4 NH3•H2O ==AlO2- + 4 NH4+ + 2 H2O |
下列实验中,不能观察到明显变化的是
| A.把一段打磨过的镁带放入冷水中 |
| B.把Cl2通入FeCl2溶液中 |
| C.把绿豆大的钾投入水中 |
| D.把溴水滴加到KI淀粉溶液中 |
以下说法错误的是
| A.在钠、钾、铷3种单质中,钠的熔点最高 |
| B.1 molNa2O2与1 mol Na2O所含阴离子的物质的量都是1 mol |
| C.标准状况下,22.4 LSO3的物质的量是1 mol |
| D.Fe与I2在加热条件下发生反应的产物为FeI2 |
下列各组物质中化学键类型相同的是
| A.HCl、MgCl2、NH4Cl | B.H2O、Na2O、CO2 |
| C.CaCl2、NaOH、H2O | D.NH3、H2O、CO2 |
1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子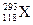 的中子数与电子数之差为
的中子数与电子数之差为
| A.0 | B.57 | C.118 | D.175 |
13C-NMR(NMR:核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖。下面有关13C、15 N叙述正确的是
N叙述正确的是
A.13C与15N有相同的中子数B.13C与C60互为同素异形体
C.15N 与14N 互为同位素D.15N的核外电子数与中子数相等