据《读卖新闻》报道,日本海洋研究开发机构正在开发一项使用镍催化剂将二氧化碳转化成甲烷的新技术。实验室模拟该过程的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
| A.反应速率υ(H2)=0.16mol•L-1•min-1 |
| B.容器体积扩大为4L,平衡向逆反应方向移动 |
| C.向体系中再充入1molH2,CO2的转化率增大 |
| D.此条件下该可逆反应的平衡常数K=25 |
已知原子序数,可能推断原子的 ( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图
⑦元素在周期表中的位置
| A.①②③④⑥ | B.①④⑤⑥⑦ | C.②③④⑤⑦ | D.③④⑤⑥⑦ |
某化学反应2A B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
温度 |
0min |
10min |
20min |
30min |
40min |
50min |
60min |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
依上述数据,下列选项错误的是:
A在实验1中,反应在10至20 min时间内平均速率为0.013mol·(L·min)-1。
B在实验2中,A的初始浓度c2="1.0" mol/L,反应经20 min就达到平衡,推测实验2中还可能隐含的条件是:使用了合适的催化剂。
C设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1,且c3>1.0 mol/L
D比较实验4和实验1,可推测该反应是放热反应
在元素周期表主族元素中。甲元素与乙、丙、丁三元素紧密相邻。甲、乙的原子序数之和等于丙的原子序数。这四种元素原子的最外层电子数之和为20。下列判断正确的是
| A.原子半径:丙>乙>甲>丁 |
| B.丁或甲与乙所形成的化合物都是有毒的物质 |
| C.最高价氧化物的对应水化物的酸性:丁>甲 |
| D.气态氢化物的稳定性:甲>丙 |
在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g);ΔH<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是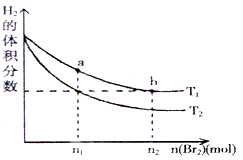
| A.由图可知:T2>T1 |
| B.两点的反应速率:a>b |
| C.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
| D.a点比b点体系的颜色深 |
用下列物质冶炼金属的过程中,需要加入还原剂的是
| A.Fe2O3 | B.Al2O3 | C.HgO | D.Cu2S |