下列说法不正确的是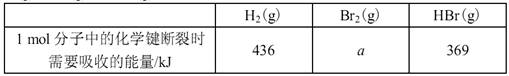
| A.若2H2(g)+O2(g)=2H2O(g) ΔH=―483.6 kJ·mol-1,则 H2燃烧热为-241.8 kJ·mol-1 |
| B.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
| C.H2(g)+Br2(g)=2HBr(g) ΔH=―72kJ·mol-1其它相关数据如上表:则表中a=230 |
| D.在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ 热量。则热化学方程式为Fe(s)+S(s)=FeS(s);ΔH=-95.6 kJ·mol-1 |
8.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
| A.同物质的量浓度的三种溶液的pH:a>b>c |
| B.同pH时,三种溶液稀释相同倍数后,pH:a=b<c |
| C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c |
| D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
7.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。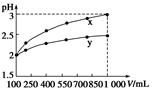
分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则
| A.x为弱酸,Vx<Vy | B.x为强酸,Vx>Vy |
| C.y为弱酸,Vx<Vy | D.y为强酸,Vx>Vy |
6.对达到平衡状态的可逆反应:X+Y  W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是:
W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是: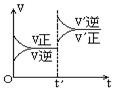
| A.X、Y、W为气体,Z不是气体 |
| B.X、Y为气体,W、Z中有一种是气体 |
| C.W、Z为气体,X、Y中有一种是气体 |
| D.W、Z中有一种为气体,X、Y都不是气体 |
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O 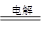 KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+ |
| C.当电解过程中转移3mole-时,理论上可制得KIO3 107g |
| D.电解前后溶液的pH几乎不变 |
4.下列电离方程式中正确的是
| A.NaHCO3溶于水:NaHCO3=Na++H++CO32- |
| B.NaHSO4熔化:NaHSO4=Na++H++SO42- |
C.HF溶于少量水中:2HF H++HF2一 H++HF2一 |
| D.(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一 |