将E 和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 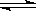 2G(g)。
2G(g)。
若忽略固体体积,平衡时 G 的体积分数随温度和压强的变化如下表所示。请填写下列空格: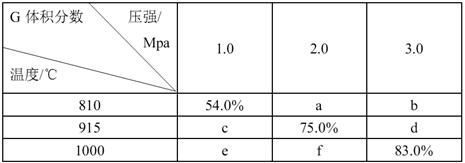
(1)表中数据b f。(选填“>”、“<”或“=”)
(2)该反应的熵变ΔS 0,ΔH 0。(选填“>”、“<”或“=”)
(3)根据表中数据,可计算求得915℃、2.0MPa时E 的转化率为 。
(4)上述反应达到平衡后,若保持体系温度不变,下列措施中能提高混合体系中气体E的体积分数的是
| A.保持容器容积不变,充入一定量的气体 E |
| B.保持容器内压强不变,充入一定量的气体 G |
| C.加入少量固体F的粉末 |
| D.保持容器容积不变,同时充入一定量的气体 E 和G |
下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O,________________是强电解质;______________是弱电解质
向100 ml浓硫酸中加入64 g铜片,加热一段时间后,至不再反应为止,请回答下列问题:
(1)写出反应的化学方程式:。
(2)若反应中有1.5 mol电子转移,被还原的硫酸为mol,标准状况下生成的SO2气体体积为L。
(3)将(2)反应后液体过滤,加水稀释滤液至500 ml,加足量Zn粉,经足够长的时间后,放出标准状况下6.72L H2,则反应的Zn的质量为g,原浓硫酸的物质的量浓度为mol·L-1。
某硫酸厂以硫铁矿为原料生产硫酸,主要过程的化学反应情况如下:
| 生产过程 |
化学反应 |
反应情况 |
| 硫铁矿的燃烧 |
4+11O2 2Fe2O3+8SO2 2Fe2O3+8SO2 |
4%的硫元素损失而混入炉渣 |
| SO2的接触氧化 |
2SO2+O2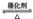 2SO3 2SO3 |
SO2转化率为95% |
| SO3的吸收 |
SO3+H2O=H2SO4 |
SO3的吸收率为98% |
(1)将硫铁矿燃烧的化学方程式补充完整:4+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)该厂现用100吨含硫40%的硫铁矿生产硫酸,可生产98%的浓H2SO4多少吨?(除上述硫的损失外,忽略其它损失)
甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体,丁为黄色固体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:



(1)按要求写出下列物质的化学式:
乙:B:
(2)写出溶液C与氯水反应的离子方程式:
(3)在催化剂和加热条件下,A可与丙反应,化学方程式为:
下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为
(2)若A为有臭鸡蛋气味的气体,C为H2SO3的酸酐,则B为:,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为