利用下列装置分别完成相关实验,能达到实验目的的是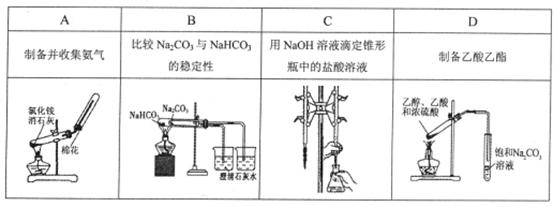
将0.1mol·L—1的某二元弱酸(H2X)溶液和0.1mol·L—1 NaOH溶液等体积混合后(忽略混合前后溶液体积变化),下列关系式中错误的是()
|
| A.c(HX—)+c(X2—)+c(H2X)=0.05mol·L—1 |
B.c(HX—)<c(X2—) |
| C.c(Na+)>c(HX—) | |
| D.c(H+)+c(Na+)=c(OH—)+c(HX—)+2c(X2—) |
固体NH4I放入一个体积为V L的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)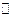 NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g) 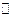 H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是( )
| A.平衡时氨气为2.5 mol |
| B.平衡时HI的分解率为20% |
| C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol |
| D.其他条件不变,把容器的体积缩小到L,重新达平衡时H2的浓度是原平衡的2倍 |
X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是()
| A.127R—的核外含有54个电子 |
| B.Y、Z、R的氢化物对应酸的酸性逐渐增强 |
| C.有l molY的单质与水发生反应则转移电子的物质的量为2 mol |
| D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色 |
下列方程式书写正确的是()
| A.等物质的量的Ba(OH)2与KAl(SO4)2溶液混合的离子方程式: 3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
B.NaHCO3水解的离子方程式:HCO3-+ H2O  CO32-+H3O+ CO32-+H3O+ |
| C.K37ClO3与浓盐酸反应制氯气的化学方程式: K37ClO3 + 6HCl(浓)  K37Cl + 3Cl2↑+ 3H2O K37Cl + 3Cl2↑+ 3H2O |
| D.表示乙醇燃烧热的热化学方程式(△H的绝对值正确): |
 ;
;
“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是( )
| A.2Na + 2H2O=2NaOH + H2↑是酸碱反应 |
B.ClO-+ H2O HClO + OH-是酸碱反应 HClO + OH-是酸碱反应 |
| C.碱性强弱顺序:ClO—>OH—>CHCOO— |
| D.HCO3-既是酸又是碱,NH3既不是酸又不是碱 |