取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L.NO2气体和0.672 L N2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
| A.1 :1 | B.2 :1 | C.2 :3 | D.3 :2 |
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:
关于茉莉醛的下列叙述错误的是()
| A.在加热和催化剂作用下,能被氢气还原 | B.能被高锰酸钾酸性溶液氧化 |
| C.在一定条件下能与溴发生取代反应 | D.不能与氢溴酸发生加成反应 |
甲醛在一定条件下发生如下反应:2HCHO+NaOH HCOONa+CH3OH,在此反应中关于甲醛的下列叙述中正确的是()
HCOONa+CH3OH,在此反应中关于甲醛的下列叙述中正确的是()
| A.仅被氧化 | B.仅被还原 |
| C.既被氧化又被还原 | D.既未被氧化又未被还原 |
一般情况下,下列官能团中既具有氧化性又有还原性的是()
| A.—OH | B.—CHO | C.—SO3H | D.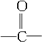 |
已知丁基有4种,据此不必试写,即可断定C5H10O的醛应有()
| A.3种 | B.4种 | C.5种 | D.6种 |
下列醇中能发生消去反应,但不能被催化氧化成相同碳原子数的醛或酮的是()
| A.甲醇 | B.2-甲基-2-丁醇 |
| C.2-丙醇 | D.3,3-二甲基-2-丁醇 |