图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁:E是不溶于水的酸性氧化物,能与氢氟酸反应。
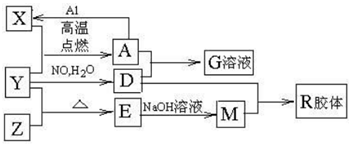
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
(2)一定条件下,Z与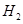 反应生成
反应生成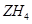 ,
,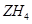 的电子式为 。
的电子式为 。
(3)已知A与1mol Al反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式: 。
(4)写出A和D的稀溶液反应生成G的离子方程式: 。
(5)问含4mol D的稀溶液中,逐渐加入X3粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2-)随n(X)变化的示意图,并标出n(X2-)的最大值。
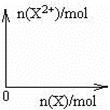
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是_______。(填序号)
①NaAlO2 ② Ca(OH)2③Na2CO3④Al(OH)3
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是
;过一会儿,溶液颜色逐渐褪去,起作用的成分是;
(4)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式。
三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:F中的溶质 ______________; 丙____________。反应③离子方程式
H受热分解后的固体产物与金属B高温下的化学方程式:_______________________A与水反应的离子方程式。
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为_________。该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是_______。
(2)除去FeCl2溶液中少量的FeCl3最好加入_________物质。
(3)鉴别Na2CO3和NaHCO3溶液可选用_________。(填序号)
①NaOH;②Ca(OH)2;③BaCl2;④K2SO4;⑤Ca(NO3)2
(4)某溶液中有①SO42―②Mg2+③Fe2+④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
(5)将盛有18mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是()
①1.2mL②2.4mL③3.6mL④5.2mL
| A.①② | B.①③ | C.②④ | D.①④ |
某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O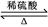 B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示: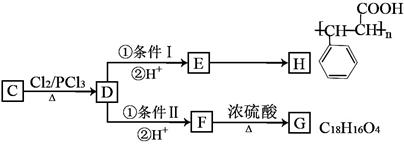
已知: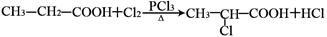
根据以上信息,回答下列问题:
(1)B的结构简式为,条件I、II中均需要的试剂为。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有个。
(3)C的同分异构体中,同时符合下列要求的物质有种。
a.苯环上有两个侧链 b.能发生银镜反应c.能发生消去反应
(4)写出G→F转化的化学方程式。
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如图所示。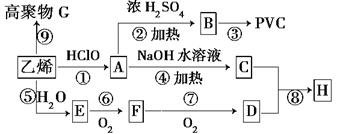
试回答下列问题:
(1)写出有机物B和G的结构简式:B,G;
(2)⑤、⑦的反应类型分别是,_______________;
(3)写出D的一种同分异构体的结构简式_____________;
(4)写出反应⑥的化学方程式__________________________________;
(5)写出C与D按物质的量之比为1∶2反应生成H的化学方程式:________________________________;