明矾石经处理后得到明矾【KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
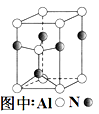
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ① 。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸 ② t。
(1)写出下列物质在水溶液中的电离方程式
氢氧化钡
硫酸铁
(2)写出下列反应的离子方程式
硫酸钠和硝酸钡
碳酸钠与足量的盐酸
(3)实验室制备氢氧化铁胶体的方法是:向沸水中逐滴加入5-6滴饱和的三氯化铁溶液,,停止加热。(请补充完整)
反应的化学方程式为。
下列物质:①Cu ② NH3 ③ NaOH溶液④ H2O ⑤ 液态HCl ⑥ 纯H2SO4 ⑦ BaSO4固体⑧ NaCl晶体 ⑨蔗糖晶体
属于电解质的是;属于非电解质的是;能导电的是。(填序号,必须填全,否则不得分)
(14分) 0.012Kg12C所含的碳原子数约为 ①个;3.01×1023个氢分子的物质的量为 ②mol;标况下,2.24L CO的物质的量为 ③mol,其中原子数目共有 ④个;1g CO与 ⑤g N2所含分子数相同;同温同压下,同体积的N2和SO2原子总数之比为 ⑥,密度之比为 ⑦。
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
⑴氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)(Ksp 沉淀离子浓度积)。
⑵物质A可使用下列物质中的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
⑶除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
⑷物质B可直接用作氮肥,则B的化学式是。
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
-- |
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是,反应的离子方程式为。
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为。