在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+  O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=  S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+ 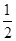 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为
| A.△H4=2/3(△H1+△H2-3△H3) |
| B.△H4=2/3(3△H3-△H1-△H2) |
| C.△H4=3/2(△H1+△H2-3△H3) |
| D.△H4=3/2(△H1-△H2-3△H3) |
改变反应条件使化学平衡向正反应方向移动,下列判断正确的是()
| A.生成物浓度一定增大 | B.生成物的物质的量分数一定增大 |
| C.反应物转化率一定提高 | D.某生成物的产率可能提高 |
对于X+Y(g) Z的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是()
Z的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是()
| A.X为气态,Z为固态 | B.X为固态,Z为气态 |
| C.X为气态,Z为气态 | D.无法确定 |
有平衡体系CO(g)+2H2(g)====CH3OH(g) ΔH<0,为增加甲醇的产量,应采取的正确措施是()
| A.高温、高压 | B.适宜的温度、高压、催化剂 |
| C.低温、低压 | D.高温、高压、催化剂 |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2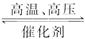 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是()
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
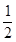 N2(g)+CO2(g) ΔH="-373.2" kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
N2(g)+CO2(g) ΔH="-373.2" kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |