在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
在一定温度下,反应A 2(g)+B 2(g) 2AB(g)达到平衡的标志是 
| A. | 单位时间内生成 nmol A 2,同时生成 nmol AB | B. | |
| C. | 容器内总压强  不随时间改变 不随时间改变 |
D. | |
| E. | 单位时间内生成2 nmol AB同时生成 nmol B 2  |
F. | 任何时间内A 2、B 2的物质的量之比为定值 |
在CO(g)+H2O(g) CO2(g)+H2(g)(正反应为放热反应)反应
中,改变下列条件,不能使v正增大的是
| A.升高温度 | B.使用催化剂 | C.降低温度 | D.增大压强 |
能增加反应物分子中活化分子的百分数的是
| A.降低温度 | B.使用催化剂 | C.增大压强 | D.增加浓度 |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.合成氨时采用循环操作,可提高原料的利用率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示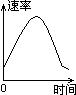 。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
| A.①④ | B.③④ | C.①②③ | D.②③ |