已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的PH=7 |
C.混合溶液中,c(H+)= 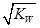 mol.L-1 mol.L-1 |
| D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-) |
下列各选项中所述的两个量,前者一定大于后者的是
| A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
有关常温下pH均为3的醋酸和硫酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
下列说法正确的是
| A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO、Cl-、CO、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- | B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:NF3+H2O→NO+HNO3+HF(没配平)。下列有关说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2∶1 |
| C.若生成0.2 mol HNO3,则转移0.2 mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |