25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) |
| B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: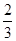 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
二氧化碳加氢制甲烷过程中的主要反应为
在密闭容器中, 、 时, 平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如题图所示。 的选择性可表示为 。下列说法正确的是( )
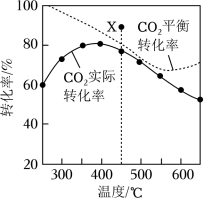
| A. |
反应 的焓变 |
| B. |
的平衡选择性随着温度的升高而增加 |
| C. |
用该催化剂催化二氧化碳反应的最佳温度范围约为 |
| D. |
时,提高 的值或增大压强,均能使 平衡转化率达到 点的值 |
室温下,用含少量 的MnSO4溶液制备 的过程如题图所示。已知 , 。下列说法正确的是( )

| A. |
溶液中: |
| B. |
“除镁”得到的上层清液中: |
| C. |
溶液中: |
| D. |
“沉锰”后的滤液中: |
室温下,探究 溶液的性质,下列实验方案能达到探究目的的是( )
|
选项 |
探究目的 |
实验方案 |
|
A |
溶液中是否含有 |
向 溶液中滴加几滴新制氯水,再滴加 溶液,观察溶液颜色变化 |
|
B |
是否有还原性 |
向 溶液中滴加几滴酸性 溶液,观察溶液颜色变化 |
|
C |
是否水解 |
向 溶液中滴加 滴酚酞试液,观察溶液颜色变化 |
|
D |
能否催化 分解 |
向 溶液中滴加几滴 溶液,观察气泡产生情况 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
金属硫化物( )催化反应 ,既可以除去天然气中的 ,又可以获得 。下列说法正确的是( )
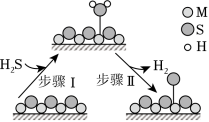
| A. |
该反应的 |
| B. |
该反应的平衡常数 |
| C. |
题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的 与催化剂中的 之间发生作用 |
| D. |
该反应中每消耗 ,转移电子的数目约为 |
化合物 是合成药物非奈利酮的重要中间体,其合成路线如图:
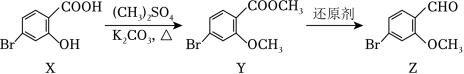
下列说法正确的是( )
| A. |
不能与 溶液发生显色反应 |
| B. |
中的含氧官能团分别是酯基、羧基 |
| C. |
最多能与 发生加成反应 |
| D. |
可用饱和 溶液和 银氨溶液进行鉴别 |