下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
下列分子中所有原子都满足最外层为8电子结构的是()
| A.CS2 | B.PCl5 | C.HClO | D.BeCl2 |
将20 mL NO2和NH3的混合气体,在一定条件下充分反应,化学方程式为: 6NO2+8NH3=7N2+12H2O,已知参加反应的NO2比参加反应的NH3少2 mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是()
①3:2②2:3③3:7④3:4
| A.①③ | B.②④ | C.①② | D.③④ |
根据下图,下列判断中不正确的是()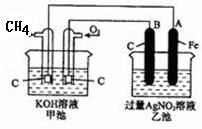
| A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下) |
36g碳不完全燃烧所得气体中,CO占三分之一体积,CO2占三分之二体积。已知:2C(s)+O2(g)=2CO(g)△H=-110.5kJ/mol,2CO(g)+O2(g) =2CO2(g)△H=-566kJ/mol,与这些碳完全燃烧相比,损失的热量是()
| A.172.5kJ | B.1149kJ | C.517.5kJ | D.283kJ |
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是()
| A.X能形成化学式为NaXO3的含氧酸钠盐 |
| B.X元素气态氢化物的水溶液呈酸性 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |