【改编】下列有关化学用语表示正确的是
A.硫离子结构示意图: |
B.水的电子式: |
C.CO2的比例模型: |
D.氮气的结构式为: |
下列物质的使用不涉及化学变化的是
| A.明矾用作净水剂 | B.生石灰作干燥剂 |
| C.氢氟酸刻蚀玻璃 | D.液氨用作制冷剂 |
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质④不锈钢和目前流通的硬币都是合金⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑥豆浆和雾都是胶体。上述说法正确的是
| A.①②④⑤ | B.①③④⑥ | C.①⑤⑥ | D.②③④⑤ |
下列有关化学用语的表示正确的是
| A.中子数为18的氯原子:3517Cl |
B.二氧化碳分子的比例模型: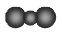 |
C.HClO的电子式: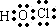 |
D.对羟基苯甲醛的结构简式: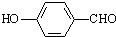 |
化学与人类生产、生活、社会可持续发展密切相关,下列有关说法正确的是
| A.某地燃烧化石燃料排放的废气中含CO2、SO2,使雨水pH=6形成酸雨 |
| B.水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 |
| C.高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 |
| D.人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
用无机矿物资源生产部分材料,其产品流程示意图如下:下列有关说法不正确的是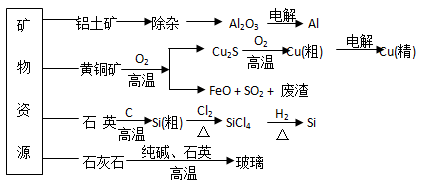
| A.制取玻璃和粗硅的同时均产生CO2气体 |
| B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
| C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 |
| D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |