【改编】下列说法中,不正确的是
| A.反应热指的是反应过程中放出或吸收的热量 |
| B.原电池的正极发生氧化反应 |
| C.化学变化一定伴随能量变化 |
| D.升温反应速率一定加快 |
下列离子方程式书写正确的是
| A.铜与稀硝酸反应:Cu+4H++2NO3-=Cu2++NO2↑+2H2O |
| B.醋酸溶液与碳酸氢钠溶液反应:H++HCO3-=H2O+CO2↑ |
| C.氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| D.硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+=H2O+BaSO4↓ |
下列中的实验一定不会出现沉淀现象的是
| A.CO2气体通入Na2SiO3溶液中 | B.SO2气体通入BaCl2溶液中 |
| C.CO2气体通入饱和Na2CO3溶液中 | D.SO2气体通入Ba(OH)2溶液中 |
如图所示的实验操作中,正确的是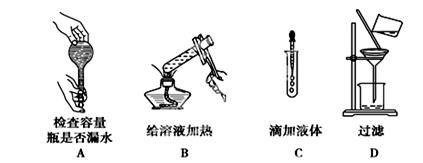
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是
| A.2F2+2H2O=4HF+O2↑ | B.C+H2O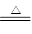 CO+H2 CO+H2 |
| C.2Na+2H2O=2NaOH+H2↑ | D.3NO2+H2O=2HNO3+NO |
113号元素原子(质量数是284)的中子数与质子数之差是
| A.171 | B.0 | C.58 | D.60 |