(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
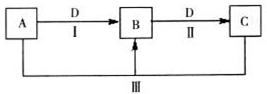
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为________________,相同温度下的溶解度B___________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性硅酸盐产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300 ℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式______________________________________________。
(2)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为__________
(3)沸石是一种含结晶水的,具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为。
(4)盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是:(用离子方程式表示).
(11分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
①该电解槽的阳极反应式是____________________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因
③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出
粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。
请完成下列问题:
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________________________________
(3)写出由F生成G的离子方程式________________________________________
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为_________。
某河道两旁有甲、乙两厂,它们排放的工业废水中,共含有K+、Ag+、Fe3+、 NO3- 、 Cl-、OH-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是:
乙厂的废水中含有另外三种离子。如果加一定量(填“活性炭”、“硫酸亚铁”或“铁粉”),可以回收其中的金属是
2012年9月7日,云南省彝良地区连续发生5.7级地震,为了防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。过氧化物是很好的选择,下列有关过氧化物的相关问题:
(I)某一反应体系有反应物和生成物共五种物质: O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为