【改编】W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法正确的是
| A.原子半径大小比较:Z>Y>W>X |
| B.Z能够形成HZO3型化合物 |
| C.W与X形成的化合物只含有离子键 |
| D.W、X、Z只能形成一种化合物 |
某温度下,X(g)+Y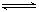 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
| A.正反应是吸热反应,Z是固体 |
| B.逆反应是放热反应,Y是固体,Z为气体 |
| C.正反应是吸热反应,只有Z不是气体 |
| D.正反应是放热反应,Y和Z均为气体 |
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH 和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是
| A.1 mol/L 60mL | B.0.5 mol/L80mL |
| C.0.5 mol/L40mL | D.1 mol/L80mL |
可逆反应:A+3B 2C+2D(各物质均为气体),在不同情况下测得有下列4 种
2C+2D(各物质均为气体),在不同情况下测得有下列4 种
反应速率,其中反应最快的是
| A.vD=0.4 mol / (L·s) | B.v C=0.5 mol / (L·s) |
| C.v B=0.6 mol / (L·s) | D.v A=0.15 mol / (L·s) |
25 ℃时,水的电离达到平衡:H2O  H++OH- ;下列叙述正确的是
H++OH- ;下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH ,平衡正向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
在一定温度下,可逆反应:A2(气)+B2(气) 2AB(气),达到平衡的标志是
2AB(气),达到平衡的标志是
| A.容器的总压强不随时间而变化 |
| B.单位时间内有n molA2生成的同时有n molB2生成 |
| C.单位时间内有n molB2发生反应的同时有n molAB分解 |
| D.单位时间内生成n molA2同时就有2n molAB生成 |