【化学与技术】合成氨工业对国民经济和社会发展具有重要意义,下图是工业合成氨的简要流程示意图。
(1)合成氨的原料气往往混有CO2等杂质,在进入合成塔之前需净化,其原因是_______ 。
(2)工业上合成氨选择的适宜条件是:以铁为主的催化剂、_______、________。
(3)沿X路线进入合成塔的物质是_______,这样设计的意义是________。
(4)目前工业制硝酸所采用的主要方法是_______法。
、已知有机物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。一定条件下,A、B、C、D、E有如下转化关系: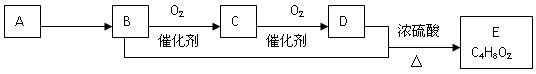
(已知:2RCHO+O2→2RCOOH)
(1)除去甲烷中混有A的试剂是。
(2)请写出B→C的方程式。
(3)请写出B与D反应生成E的化学方式。
(4)某同学设计了下列反应: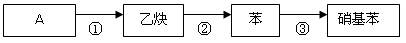
请写出③的反应方程式。
、等温、等压、等质量的气体:H2、D2、T2,则
①密度之比为②质子数之比为
③中子数之比为④体积之比为
将甲烷和乙烯的混合气体共0.2mol通入溴水中,发生反应的化学方程式是 ,反应的类型为 ,若充分反应后溴水增重2.8克,则原混合气体中甲烷和乙烯的物质的量之比为 。
下列物质中:
(1)互为同分异构体的有(2)互为同素异形体的有
(3)属于同位素的有(4)属于同一种物质的有。(填序号)
丙烯是重要的工 业原料,以丙烯为原料合成有机玻璃和药物喹啉的流程如下:
业原料,以丙烯为原料合成有机玻璃和药物喹啉的流程如下: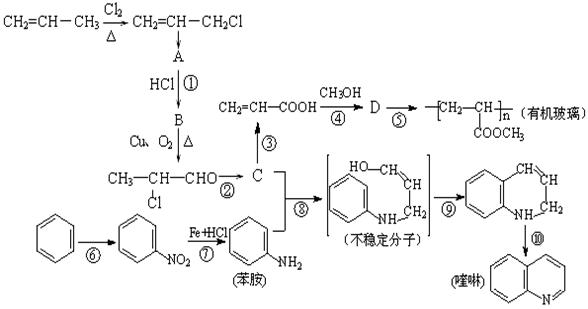
回答下列问题:
(1)结构简式A为,
(2 )①∽⑩反应中属于消去反应的有;
)①∽⑩反应中属于消去反应的有;
(3)设计反应①、②的目的是;
(4)D的同分异构体E能进行银镜反应,且核磁共振氢谱如右图,E的结构简式为;
(5)写出下列反应的化学方程式:
反应②;
反应⑦。