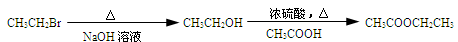【原创】Ⅰ.A、B、C、D、E、F是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):

(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素, F为强碱(部分产物略去),则B+D→E的离子方程式为 ,C为同周期元素构成的1∶1型化合物,则C的电子式为 。
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 ,A+B→C+D的化学方程式为 。
Ⅱ.(共10分)白色固体X(仅含四种元素),在造纸工业中用作木质素脱除剂,纺织工业中用作人造纤维的稳定剂,电子工业中制造光敏电阻,食品工业中用作抗氧化剂。某研究小组为了探究X的组成和性质,设计并完成了如下实验:

另取25.20gX在惰性气流中加热,低于150℃时得到12.60g固体,温度高于150℃时完全分解得到1.95g固体Y和10.65g固体Z。请回答下列问题:
(1)X的化学式为 ,固体Y的电子式 。温度高于150℃时完全分解得到固体Y和固体Z的化学方程式为 。
(2)固体Y的水溶液,露置于空气中会有什么现象产生。写出发生该现象的化学方程式: 。
(3)一定条件下,固体Z与木炭混和加强热能发生氧化还原反应,写出其可能的氧化还原反应方程式 ;并设计实验方案验证该反应生成的固体产物 。
食品防腐剂能防止由微生物引起的腐败变质、延长食品的保质期。
芳香族化合物甲是一种食品防腐剂,其相对分子质量为122,且能与NaHCO3溶液反应生成CO2。
(1)甲的结构简式是 , 芳香族化合物乙与甲互为同分异构体,能与NaOH溶液反应,但不能使FeCl3溶液显紫色,写出乙与NaOH溶液反应的化学方程式: 。
有机物H(尼泊金乙酯)也是一种常见的食品防腐剂,其生产过程如下:(反应条件未全部注明)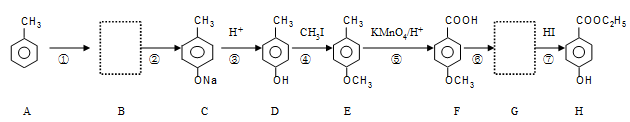
完成下列问题:
(2)有机物D的名称 ;有机物G的结构简式_____________。
反应⑥的试剂和条件是 。
(3)不能与H反应的物质是 。(选填字母)
a.NaHCO3溶液 b.NaOH溶液 c.FeCl3溶液 d.浓Br2水
(4)D有多种同分异构体,写出一个与D不同类且含苯环的结构简式:__________________。
(5)反应④和⑦的目的是____________________________________。
反应②的化学方程式是 。
米格列奈是一种非磺脲类胰岛素促分泌的药物,可由A (苯甲醛)为原料合成,部分合成路线如下:
完成下列填空:
(1)化合物C中含氧官能团为 、 (填名称)。
(2)由B→C、F→G的反应类型依次为 、 。
(3)D和E发生取代反应生成F的同时有HCl生成,则E的结构简式是 。
(4)X (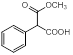 )为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式 。
)为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式 。
①能发生银镜反应,与FeCl3不发生显色反应,但其水解产物之一能与FeCl3溶液发生显色反应。②分子中有4种化学环境不同的氢原子。
(5)已知:① RCHO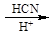
 ②
②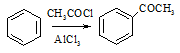
根据已有知识并结合相关信息,写出以 为原料制备
为原料制备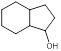 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C=CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
M是一种单质,A、B、C、D、E、F、G都是含有同一种元素的物质,这七种物质相互转变的关系如下图所示:
(1)写出下列物质的颜色:
M F ,
(2)写出下列变化的化学方程式
A→B: 该反应中每消耗0.3 mol的A,可转移电子 mol。
E→G ;
D→C 。
(3)上述反应中,属于氧化还原反应的有 个
下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。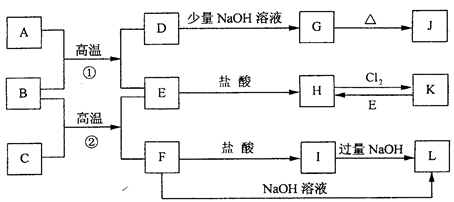
请回答下列问题:
(1)D的电子式为__ ___。
(2)K的化学式为___ ___。
(3)写出B与C高温反应生成E和F的化学方程式:___ __。
(4)写出D与J的稀溶液反应生成G的离子方程式:__ ___。
奈必洛尔是一种用于血管扩张的降血压药物。用于合成奈必洛尔中间体G的部分流程如下: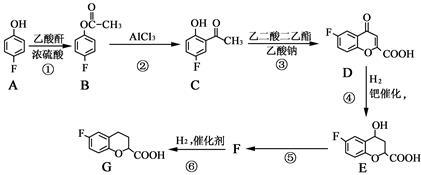
已知:乙酸酐的结构简式为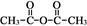
请回答下列问题:
(1)G物质中的含氧官能团的名称是 、 。
(2)反应A→B的化学方程式为 。
(3)上述④、⑤变化过程的反应类型分别是 、 。
(4)写出满足下列条件的C的同分异构体的结构简式: 、
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以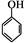 和乙酸酐为原料制备
和乙酸酐为原料制备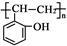 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: