(15分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验: 
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,
下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 |
操作 |
实验现象 |
结论 |
| 1、检验Cl— |
取少许滤液于试管中, , |
, |
含有Cl— |
| 2、检验NH4+ |
取少许滤液于试管中, , |
, |
含有NH4+ |
| 3、检验Zn2+ |
取少许滤液于试管中,加入稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质,若要将所得固体溶质中的物质加以分离,可用 法。
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成 高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。
高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。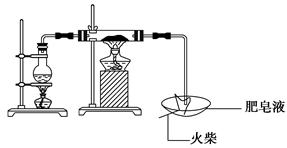
①反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当________时(填实验现象),说明“铁与水蒸气”能够进行反应。
②写出铁与水蒸气反应的化学方程式_______________。
③实验中石棉绒的作用是。
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成气体的体积,计算出铁粉的转化率。
①收集并测量气体体积应选图中的________装置。
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088 g/L,最好选用______规格的量筒(选填字母序号)。
| A.100 mL | B.200 mL |
| C.500 mL | D.1 000 mL |
实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是________________________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为_______g;根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为______mL。
(3)下图是某同学转移溶液的示意图,图中的存在的错误是_______________________。
(4)在实验中其他 操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
(15分)有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
(1)甲组同学拟选用图27题-l的实验装置完成实验:
①铝硅合金与足量稀硫酸的反应的离子方程式__________________________________。
②该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因_________________________________________
_____________ _______________________________________________________________。
_______________________________________________________________。
④实验结束时,测量实验中生成氢气的体积时应注意:a.待实验装置
冷却到(约20℃,1atm)后,上下移动量筒,使其中液面与广口瓶中
液面相平,b.______________________________________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图27题-2所示的实验装置。
装置中导管a的作用是
_________________________ ___________________________
___________________________
_____________________________________________________。
②实验中准确测得4个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则通常状况时气体摩尔体积Vm=_______L·moL-1。
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A B 。
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是。碳酸化时没有析出碳酸钠晶体,其原因是。
(3)碳酸化后过滤,滤液D最主要的成分是(填写化学式)。
(4)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:,滤液D加石灰水前先要加热,原因是 。
。
(5)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,需要测定的数据是加热前样品的质量(m1)与加热后残留固体的质量(m2),则纯碱中碳酸氢钠的质量分数为。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为
,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验状置(图 中夹持仪器省略)。
中夹持仪器省略)。 (3)装置B中试剂的作用是。
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。