下列化学用语或模型表示正确的是
A.钠离子的结构示意图: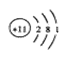 |
B.CO2分子的比例模型: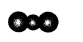 |
| C.乙醇分子的结构简式:CH3CH2OH |
| D.中子数为2的氢原子符号:12H |
下列两种溶液反应,将第一种溶液滴入第二种溶液与将第二种溶液滴入第一种溶液时发生的反应不完全相同的是()
①AlCl3与NaOH ②AgNO3与氨水 ③Na3PO4与H2SO4 ④NaAlO2与盐酸 ⑤苯酚钠与盐酸
| A.①②⑤ | B.①②③④ | C.②③⑤ | D.全部 |
某无色透明溶液中,放入铝片,立刻有大量H2产生,则下列离子在该溶液中可以大量存在的是()
| A.OH-、NO3-、Ba2+、Cl- | B.H+、Ba2+、Mg2+、NO3- |
| C.H+、Cu2+、Al3+、SO42- | D.Na+、K+、MnO4-、Cl- |
在纯水中存在如下平衡:2H2O<==>H3O++OH-,若使水的电离平衡向逆方向移动,且使溶液中的pH减小,应加入下列的(双选) ( )
| A.NH4Cl | B.KHSO4 | C.NaOH | D.HCl |
在实验室不慎手被玻璃划破,可用FeCl3溶液紧急止血,其主要原因可能是( )
| A.FeCl3溶液具有杀菌消毒作用 | B.FeCl3溶液能使血液凝聚 |
| C.FeCl3能产生Fe(OH)3沉淀堵住伤口 | D.FeCl3溶液能使血液发生化学变化 |
氯化铁溶液与氢氧化铁胶体具有的共同性质是()
| A.分散质颗粒直径都在1nm-100nm之间 | B.能透过半透膜 |
| C.加热蒸干、灼烧后都有氧化铁生成 | D.呈红褐色 |