下列图示与对应叙述相符合的是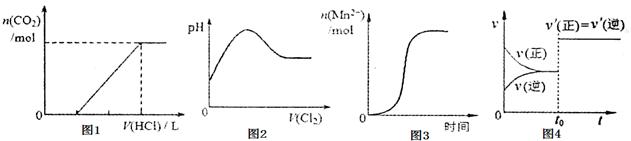
| A.图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸体积的关系 |
| B.图2表示Cl2通入SO2水溶液中,溶液pH的变化 |
| C.图3表示10mL0.01mol·L-1KMnO4酸性溶液与过量0.1mol·L-1H2C2O4溶液混合时,Mn2+浓度随时间的变化情况(已知Mn2+对该反应有催化作用) |
| D.图4表示密闭容器中的某反应达到平衡,在t0时改变某一条件反应速率(v)所发生的变化,则改变在条件可能是增大压强 |
【原创】下列各组离子在指定溶液中能大量共存的是
| A.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
| B.使甲基橙变红的溶液:Na+、Fe3+、Cl-、S2O32- |
| C.无色溶液中: K+、AlO2-、HCO3-、Cr2O72- |
| D.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
【原创】化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法正确的是
| A.光化学烟雾、臭氧空洞、温室效应、硝酸型酸雨的形成都与氮氧化物有关 |
| B.开发核能、太阳能等新能源;利用二氧化碳制造全降解塑料;使用无磷洗涤剂都可直接降低碳排放 |
| C.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
| D.SO2能使食物增白,甲醛能给食物保鲜,但都会严重损害人体健康,故食品中应该严格控制使用 |
常温下,对下列四种溶液的叙述正确的是
| ① |
② |
③ |
④ |
|
| pH |
10 |
10 |
4 |
4 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 2A(气)+B(气) 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小;
③2 s 时物质 A 的转化率为70%
④达到平衡状态时,增加A物质的量A和B转化率都提高。
⑤当各物质浓度满足c(A)="2c(B)=" c(C)时,该反应达到了平衡状态;
其中正确的是
A.①③ B.①② C.②③ D.③④
【原创】下列有关离子反应的表达或描述正确的是
| A.H218O中投入Na2O2固体,离子方程式为:2H218O + 2Na2O2 = 4Na+ + 4OH- + 18O2↑ |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合,离子方程式为:Ba2++2OH-+NH4++HCO3-= BaCO3↓+NH3·H2O+H2O |
| C.若溶液中由水电离产生的c(OH-)=1×10-12mol/L,则K+、I-、NO、Cl-一定能大量共存 |
| D.向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明原溶液不含NH4+ |