下列说法错误的是
| A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B.能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 |
| C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 |
| D.用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
硫蒸气中常含S2分子,常温下硫则常以S8的形式存在,下列说法正确的是( )
| A.相同物质的量的S2与S8分别与足量O2燃烧时消耗O2的质量相等 |
| B.相同质量的S2与S8分别与足量O2燃烧时消耗O2的质量相等 |
| C.标准状况下,1 mol S2的体积约为22.4 L |
| D.1 mol S8在过量O2中燃烧可生成8 mol SO3 |
设NA为阿伏加德罗常数的数值,下列说法错误的是()
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA |
| C.24 g NaH中阴离子所含电子总数为2 NA |
| D.标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |
下列有关化学用语正确的是()
A.乙炔的结构简式:CHC.次氯酸的电子式
C.H、D、T表示同一种核素 D.CH4分子的球棍模型: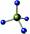
有一铝、铁混合物样品,取等质量的该样品两份,分别加入到足量的NaOH溶液和足量的稀盐酸中,放出H2的质量之比为3:4,则该混合物中铝、铁的关系正确的是()
| A.物质的量之比为2:1 | B.物质的量之比为4:1 |
| C.质量之比为1:1 | D.质量之比为3:1 |
下列有关试剂的保存方法,错误的是()
| A.氢氧化钠溶液保存在具有橡胶塞的广口玻璃试剂瓶中 |
| B.新制的氯水通常保存在棕色玻璃试剂瓶中 |
| C.少量的钠保存在煤油中 |
| D.浓硝酸保存在棕色玻璃试剂瓶中 |