NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA |
| B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 |
| C.6.8克熔融的KHSO4混中含有0.1NA个阳离子 |
| D.标准状况下,11.2L四氯化碳所含分子数为0.5NA |
室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
| A.NH+4、Cu2+、Cl-、NO-3 | B.K+、Na+、SO2-3、S2- |
| C.K+、Na+、AlO-2、SO2-4 | D.Ba2+、Fe2+、NO-3、Br- |
实验室制Cl2的反应为4HCl(浓)+MnO2高温MnCl2+C12↑+2H2O.下列说法错误的是( )
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 molCl2,转移电子的物质的量为2 mol |
| C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
标准状况下两个容积相等的贮气瓶,一个装有O2,另一个装有CH4,两瓶气体具有相同的( )
| A.质量 | B.原子总数 | C.密度 | D.分子数 |
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.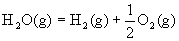 ;△H= +242kJ·mol—1 ;△H= +242kJ·mol—1 |
B.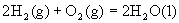 ;△H= —484kJ·mol—1 ;△H= —484kJ·mol—1 |
C. ;△H= +242kJ·mol—1 ;△H= +242kJ·mol—1 |
D.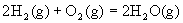 ;△H= +484kJ·mol—1 ;△H= +484kJ·mol—1 |
质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水。得到溶液每毫升的质量为qg,物质的量浓度为c。则溶质的相对分子质量为( )
A. |
B. |
C. |
D.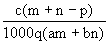 |