氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g) 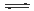 2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g) 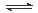 2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。


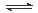 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。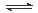 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)向FeCl2溶液中加入X的水溶液,是溶液颜色变为棕黄色的微粒是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是 。
(2)若用下列装置只进行Z + W X + Y反应(夹持装置未画出):
X + Y反应(夹持装置未画出):
①完成此实验有多步操作,其中三步是:a.点燃酒精灯,b.滴加盐酸,c.检验气体纯度
这三步操作的先后顺序是 (填字母)。
②为保证实验成功,上述装置需要改进,方法是(用文字叙述) 。
(3)将3.48 g Z加入50 mL 4 mol/L的稀HNO3中充分反应,产生112 mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多时,至少需要加入2 mol/L的NaOH溶液 mL (精确到0.1)。
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
(1)反应生成ClO2气体需要X酸酸化,X酸可以为 。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为 。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。写出pH≤2时ClO2与S2-反应的离子方程式_______ 。
(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式_____ _______;处理100 m3这种污水,至少需要ClO2 _____________ mol。
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____ _,此法的最大缺点是_ ______。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示: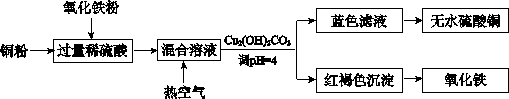
稀硫酸、铜和氧化铁反应的离子方程式是____;向混合溶液中通入热空气的反应的离子方程式是_ ____;由滤液得到无水硫酸铜的实验操作是 ______。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示: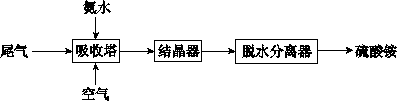
①吸收塔中发生反应的化学方程式是____ ___。
②有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的简便方法是___ ____。
在标准状况下,有:①4.8gCH4②11.2LHCl③2.408×1023个H2S气体分子④0.2molNH3
对于这四种气体而言,请用序号比较下列各项的大小。
(1)含氢原子数由多到少的顺序为_________;
(2)质量由大到小的顺序为_______________;
(3)体积由大到小的顺序为_______________;
(4)密度由大到小的顺序为_______________。
现有CO、CO2、O3三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为_________。