下列解释事实的方程式不正确的是
| A.向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++ 3NH3·H2O===Al(OH)3+ 3NH4+ |
| B.加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3+ + 3OH—="=" Fe(OH)3↓ |
C.常温下0.1mol/L 氯化铵溶液pH=5:NH4+ +H2O 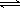 NH3·H2O+ H+ NH3·H2O+ H+ |
| D.电解精炼铜时阳极铜溶解:Cu — 2e— ="==" Cu2+ |
下列关于晶体的叙述中,错误的是()
| A.每摩尔Si晶体中,含有2摩尔Si-Si共价键 |
| B.在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子 |
| C.在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+ |
| D.在简单立方堆积的金属晶体中,每个金属原子周围紧邻的有6个金属原子 |
几种短周期元素的原子半径及主要化合价如下表: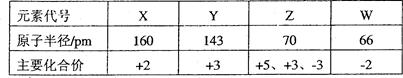
下列叙述正确的是()
| A.X、Y元素的第一电离能 X<Y |
| B.Z、W元素电负性Z>W |
| C.Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D.一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
下列化学式既能表示物质的组成,又能表示物质的一个分子的是()
| A.NaOH | B.SiO2 | C.Fe | D.H2O2 |
下列溶液中微粒浓度关系一定正确的是()
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-) >c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol•L-1的磷酸钠溶液中:c(Na+)>c(OH-)>c(PO43-)>c(H+) |
下列判断正确的是()
| A.已知HClO、HNO2电离常数Ka分别为3.0×10-8、4.6×10-4,0.1mol•L-1的次氯酸钠溶液的pH小于0.1 mol•L-1的亚硝酸钠溶液的pH |
| B.0.1mol•L-1的碳酸钠溶液的pH大于0.1 mol•L-1的醋酸钠溶液的pH |
| C.实验室配制硫酸铁溶液时,需要抑制Fe3+水解,可以将硫酸铁先溶于适量盐酸,然后加水稀释 |
| D.实验室制备氢氧化铁胶体的方法是向烧碱溶液中滴加氯化铁溶液,并加热至沸腾以促进铁离子的水解 |