莽草酸是合成达菲的主要原料,其结构简式如图,下列说法正确的是:
| A.分子式为C7H8O5 | B.能使溴的四氯化碳溶液褪色 |
| C.只能发生加成反应和取代反应 | D.分子中含有2种官能团 |
下列装置或操作能达到实验目的的是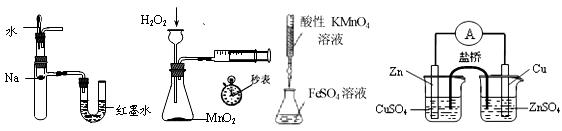
| A.验证反应的热效应 | B.定量测定化 | C.滴定FeSO4溶液 | D.构成铜锌原电池 |
学反应速率
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,
B2+与C-具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径A2-> C->B2+B.它们的原子序数A>B>C
C.它们的原子半径C>B>A D.原子最外层上的电子数C>A>B
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵ 在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶ 在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+ | B.CO32─、Na+、Al3+ |
| C.Na+、CO32─、AlO2─ | D.MnO4─、Na+、CO32─ |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)下列推断错误的是
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH—+HCO3—=H2O+CO32—,则E是一种清洁的能源
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
下列实验操作能达到目的或对实验结果的推理正确的是
| A.酸碱中和滴定前,滴定管和锥形瓶都用待装液体润洗 |
| B.用pH试纸测定CH3COONa溶液的pH,证明CH3COOH是弱电解质 |
C.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有 |
| D.将镁和铝用导线连接再插进稀NaOH溶液中,镁条上产生气泡,说明镁比铝活泼 |