几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,W单质可以将Z单质从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
短周期元素X、Y、z、W的原子序数依次增大,x原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个,Z的氧化物可做光纤电缆材料,W与X属于同一主族。下列叙述正确的是( )
| A.元素W的氢化物的热稳定性比X弱,因为X的氢化物分子间存在氢键 |
| B.四种元素形成的最高价氧化物对应水化物的酸性最强的是W |
| C.他合物YX、ZX2、WX3中化学键类型相同 |
| D.原子半径的大小顺序:r(Y)>r(Z)>r(X)>r(W) |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
将ag Mg、Al合金完全溶解在V1L、c1mol/L的盐酸溶液中,产生bgH2。再向反应后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。则下列关系式错误的是( )
| A.合金中的物质的量为(24b-a)/9mol |
| B.d=a+17b |
C. |
D.与金属反应后剩余盐酸的物质的量浓度为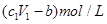 |
下列离子方程式中正确的是( )
| A.向溶液Na2FeO4中加入稀H2SO4产生氧气:4FeO42-+2OH-=4Fe2++3O2↑+10H2O |
| B.向溶液NH4Al(SO4)2中滴入溶液Ba(OH)2恰好使(SO4)2-沉淀完全2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| C.向溶液Mg(HCO3)2中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| D.向溶液Fe(NO3)2中加入稀氢碘酸:3 Fe2++4H+NO3-=3 Fe3++NO↑+2H2O |
下列关于Cl、N、S等非金属元素化合物的说法正确的是( )
| A.漂白粉的主要成分是次氯酸钙 |
| B.实验室可用浓硫酸干燥氨气 |
| C.实验室可用NaOH处理NO2和HCI废气 |
| D.Al2(SO4)3可吸附除去碱性废水及酸性废水中的悬浮颗粒 |