某小组进行电化学研究,甲同学设计如下图的装置图,乙同学利用甲的装置和桌面其他的药品与材料,不能完成的实验是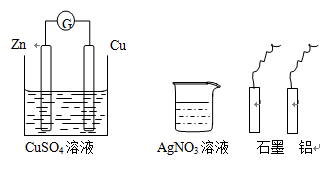
| A.使甲同学的正极变为负极 | B.设计一个新的原电池 |
| C.在碳电极上镀锌 | D.使锌电极受到保护 |
食用下列食品,通常不会对人体造成危害的是
| A.用甲醛溶液浸泡的海鲜品 |
| B.牛奶经工业发酵后得到的酸奶 |
| C.加有苏丹红Ⅰ号调色剂的鲜辣酱 |
| D.二氧化硫熏制后的白面粉 |
生活中的一些问题常涉及化学知识,下列叙述正确的是
| A.过多食用糖类物质如淀粉等不会致人发胖 |
| B.纤维素在人体消化过程中起重要作用,纤维素可以作为人类的营养物质 |
| C.淀粉在人体内直接被吸收,供人体组织的营养需要 |
| D.棉花的主要成分是纤维素 |
下列物质都是常见的食品添加剂,可用作防腐剂但必须严格控制用量的是
| A.亚硝酸钠 | B.食盐 | C.蔗糖 | D.味精(谷氨酸钠) |
下列物质不属于天然高分子化合物的是
| A.淀粉 | B.纤维素 | C.油脂 | D.蛋白质 |
下列说法正确的是
| A.绿色食品就是指颜色为绿色的食品 |
| B.白色污染是指白色的废弃物的污染 |
| C.有机食品是指含有有机物的食品 |
| D.食盐加碘实质是在食盐中加入KIO3 |