【改编】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
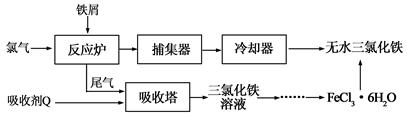
(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式: 。
(2)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为___________________________________。
(3)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(4)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。(已知:I2+2S2O32-=2I-+S4O62-))
①滴定终点的现象是: 。
②样品中氯化铁的质量分数为 (用字母m、c、V来表示)。
(6)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+– 2e-= 2Fe3+
阴极反应为:___________________
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):_______________________
下图是常见物质之间的转化关系。氧化物A是光导纤维的基本原料,单质Ⅰ、Ⅲ为非金属单质,单质Ⅱ为主族元素对应的金属单质。请回答:
(1)氧化物A的化学式:。单质Ⅱ与NaOH溶液反应的化学方程式。
(2)向盐甲的水溶液中通入过量的CO2,观察到的现象是 。
(3)单质Ⅰ的用途非常广泛,如用做(写一种即可)。
(4)盐乙的溶液呈现(填“酸性”或“碱性”或“中性”)。
有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
(1)将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
________+Na2SO3+________→________+________+________+H2O
(2)反应物中发生氧化反应的物质是_________(填化学式),被还原的元素是_______。
(3)反应中1mol氧化剂_______(填“得到”或“失去”)________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
□__________ +□__________ +□__________ →
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的______ 极,发生的电极反应为__________;X电极上发生的电极反应为____________;
(3)外电路中的电子是从_______电极流向________电极。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是:
①_________,②__________,③____________,④_________,⑤_________________。
(2)图中现象a、b、c表明检验出的离子分别是:A____________、b____________、c_______________。
(3)白色沉淀A加试剂②反应的离子方程式是_________________________。
(4)无色溶液C加试剂③的主要目的是___________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是__________________________。
(6)气体E通入试剂④发生反应的离子方程式是____________________________________。
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C,D,E。
(2)写出下列反应的化学方程式:
A和水生成E:。
②B和D生成C:。
③Cl2与E的水溶液:。