下列图示与对应的叙述相符的是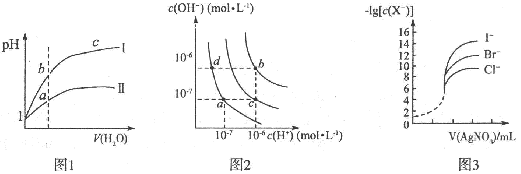
| A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.图2中纯水仅升高温度,就可以从a点变到c点 |
| C.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
| D.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
已知在298K时下述反应的有关数据:
①C(s)+ O2(g)═CO(g)△H1=﹣110.5kJ•mol﹣1
O2(g)═CO(g)△H1=﹣110.5kJ•mol﹣1
②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ•mol﹣1
则C(s)+CO2(g)═2CO(g) 的△H 为
| A.+283.5kJ•mol﹣1 | B.+172.5kJ•mol﹣1 |
| C.﹣172.5kJ•mol﹣1 | D.﹣504kJ•mol﹣1 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是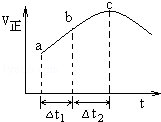
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+ (aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH3>ΔH2 | D.ΔH1>ΔH3>ΔH2 |
已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是
①生成物的质量分数一定增加 ②生成物的产量一定增大 ③反应物的转化率一定增大
④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
| A.①② | B.②③⑤ | C.②⑤ | D.④⑥ |
充分燃烧一定量丙烷气体放出的热量为QkJ,完全吸收它生成的CO2恰好转化成酸式盐需6 mol·L-1的NaOH溶液100 mL,则丙烷的燃烧热为
| A.-16QkJ/mol | B.-5Q kJ/mol |
| C.-4Q kJ/mol | D.-2Q kJ/mol |