某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式______________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式__________________________________。
(3)C中盛放CCl4的作用是__________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是______________。
(12分) 过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
(1)第②步反应的化学方程式为 。
(2)可循环使用的物质是 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
(3)检验CaO2·8H2O是否洗净的方法是 。
(4)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是______、______。
(5)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
(12分)(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________。
(5)装置B内溶液吸收的气体是____________。
(6)(NH4)2SO4在400℃分解的化学方程式是_____________。
已知草酸镍晶体(NiC2O4,2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示: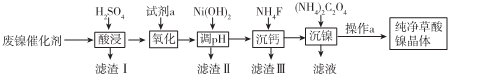
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
(1)请写出一种能提高酸浸速率的措施____。
(2)pH试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式 。
(3)pH的调控范围为 ,试用化学反应原理的相关知识解释滤渣Ⅱ的生成
(4)写出“沉镍”时反应的离子方程式 ,证明Ni2+已经沉淀完全的实验步骤及现象
是 ,当Ca2+沉淀完全时,溶液中c(F-)>(写出计算式即可)。
(5)操作a的内容是 。
Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2。某科学小组通过实验验证反应产物并探究产物的比例关系。资料信息:

限用如下装置实验(夹持装置省略,部分仪器可重复使用)
(1)装置连接的顺序为 (填字母序号);
(2)连接好仪器,装入药品前检验装置气密性的方法是____;
(3)装置A中盛装的干燥剂是 ;装置F的作用__ __;
(4)验证产物中存在Mg3 N2的具体实验操作为 .确定产物中有N。生成的实验现象为 ;
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:_ _。
回答实验室配制0.1 mol/L的NaOH溶液500 mL实验中的下列问题。
(1)需NaOH_________g。
(2)有以下仪器:
①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平
配制时,必须使用的仪器有___________,还缺少的仪器是______________。
(3)下列称量NaOH的操作中,正确的是_______________。(填序号,下同)
①把NaOH直接放在托盘上称量
②把NaOH放在纸上称量
③把NaOH放入烧杯中称量
(4)使用容量瓶前必须进行的一步操作是________。
(5)配制的,一般可分为以下几个步骤:
①称量,②计算,③溶解,④摇匀,⑤转移,⑥洗涤,⑦定容,⑧冷却。
其正确的操作顺序为(“步骤”不重复)________ _____。
(6)配制过程中,下列操作会引起误差偏高的是________。
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容时俯视刻度