如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中不正确的是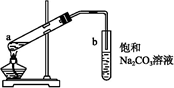
| A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇和冰醋酸 |
| B.试管b中导气管下端管口不能插入液面以下的目的是防止实验过程中产生倒吸现象 |
| C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
| D.试管b中饱和碳酸钠溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,
2Z(g)的平衡常数为1 600。此温度下,
在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下: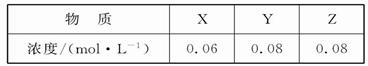
下列说法正确的是
| A.此时v(正)<v(逆) |
| B.平衡时Y的浓度为0.05 mol·L-1 |
| C.平衡时X的转化率为40% |
| D.增大压强使平衡向正反应方向移动,平衡常数增大 |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用石墨作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
| A.a=3 | B.a=2 |
| C.B的转化率为40% | D.B的转化率为60% |
下列叙述中不正确的是
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.不能自发进行的氧化还原反应可通过电解的原理实现 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入数滴氯化铜溶液 | B.加入适量的6 mol·L-1的盐酸 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |