随着社会的发展,人们日益重视环境问题,下列说法不正确的是
| A.绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 |
| B.对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 |
| C.采用催化转换技术可将汽车尾气中的NOx和CO转化为无毒气体 |
| D.CO2和SO2是造成酸雨的主要污染物,因此我们要提倡节能减排 |
下列物质属于电解质的是
| A.熔融的NaCl | B.KNO3溶液 | C.Na | D.乙醇 |
已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COOH溶液,下列说法正确的是
| A.CH3COONa溶液中,c(CH3COO-)> c(Na+) >c(OH-) >c(H+) |
| B.在相同条件下,两溶液的pH大小为:CH3COONa<NaF |
| C.两溶液相比较,CH3COONa溶液中的离子总数多 |
| D.CH3COONa溶液中,c(H+)+c(CH3COOH)=c(OH-) |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
数[j(C)]在温度(T)和压强(P)的条件下随时间(t)变化如下图所示,下列叙述正确的是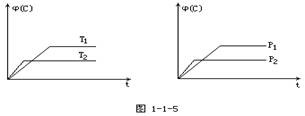
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越
来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4 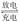 MgxMo3S4;在镁原电池放电时,下列说法错误的是
MgxMo3S4;在镁原电池放电时,下列说法错误的是
| A.Mg2+向正极迁移 |
| B.正极反应为:Mo3S4+2xe-=Mo3S42x- |
| C.Mo3S4发生氧化反应 |
| D.负极反应为:xMg-2xe-=xMg2+ |