某实验小组的同学用氢氧化钙和盐酸进行酸碱中和的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸,实验结束后,发现忘了滴加指示剂。他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
(1)复分解反应的发生需要一定的条件。氢氧化钙和盐酸能发生复分解反应是因为 。
(2)探究烧杯中溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是Ca(OH)2和CaCl2;猜想二:可能只有CaCl2
猜想三:可能是 。
【查阅资料】CaCl2溶液显中性。
【进行实验】
实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,若 ,说明猜想一不正确。
实验二:另取烧杯内的少量溶液于另一只试管中,逐滴加入碳酸钠溶液至过量,若 ,说明猜想二不正确,猜想三正确。
实验三:取少量烧杯内溶液于试管中,用下列物质中的 (填序号)不能说明猜想三正确。
| A.紫色石蕊 | B.氢氧化铜 | C.硝酸银 | D.锌 |
【反思与拓展】
①在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
②要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
③实验室欲中和100g 7.3% 的盐酸,至少需要多少克熟石灰?
该兴趣小组还就“H2O2生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2 生成O2的快慢与催化剂种类有关。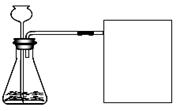 【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
【进行实验】下图是他们进行实验的装置图,
方框中为他们收集氧气的装置,此实验中宜采用的气体收集方法是。
【实验记录】如图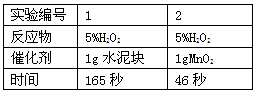
【结论】该探究过程得出的结论是。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加两个实验来分别验证和。
【拓展】H2O2生成O2 的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出另一种影响H2O2 生成O2 的快慢的因素以及相关假设和实验方案)
【假设】。
【实验方案】。
如下图是李明同学设计的实验: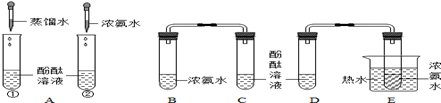
【实验目的】该实验是为了探究①分子在不断运动;② 。
【实验步骤】步骤一:向A中试管①滴加2mL蒸馏水,试管②中滴加2mL浓氨水,观察到的现象为。
步骤二:向C、D两支试管中分别加入5mL的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡.步骤三:在B、E试管分别加入2mL浓氨水,立即用带橡皮塞的导管,并按实验图连接好,并将E试管放置在盛有热水的烧杯中,观察现象
【分析讨论】(1)由A实验得出的结论是。
(2)步骤三观察到的现象是。
3)由此可以得到的实验结论是:①分子在不断运动;②。
小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。
【提出问题】该淡黄色固体的化学成分是什么?
【查阅资料】(1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
【设计实验方案】
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,你认为的最佳方案是,理由是(从环保或操作角度分析)。
【实验验证并得出结论】小明向盛有少量该固体的试管中加入2mL水,立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
小明想对生成的气体成分判断,他提出了以下两种假设:①该气体是CO②该气体是O2。
你认为上述假设哪个更合理(填“①”或“②”)。理由是是。
请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
【分析】过氧化钠与水反应的文字表达式为。
【计算】78克过氧化钠与多少克二氧化碳中所含氧元素的质量相等?(列式计算)
实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程式:;
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除Mn02、CuO外,Fe203也可以作KCl03分解的催化剂.
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 |
实验药品 |
分解温度(℃) |
| ① |
KCl03 |
580 |
| ② |
KCl03、Mn02(质量比1:1) |
350 |
| ③ |
KCl03、CuO(质量比l:1) |
370 |
| ④ |
KCl03、Fe203(质量比1:1) |
390 |
【分析数据、得出结论】
(1)由实验与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是.
【反思】
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证;
(3)同种催化剂,还有哪些因素可能影响催化效果,请你再探究(探究一种因素即可).
图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味.于是小明对原实验装置进行了改进,装置如图Ⅱ.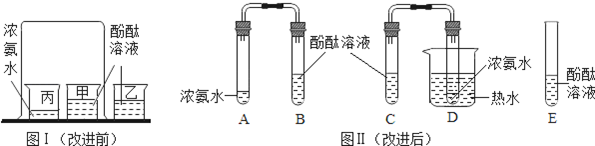
实验操作:
a:向B、C、E三支试管中分别加入5 mL的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡,观察溶液颜色.
b:在A、D试管分别加入2 mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟.
分析讨论:
(1)E试管放有酚酞溶液的目的是.
(2)进行操作b时观察到的现象是.
(3)由此可以得到的实验结论是①,②.
(4)对比改进前的实验,改进后实验的优点是.