根据下表提供的数据,下列判断正确的是
| 弱酸的化学式 |
CH3COOH |
HClO |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
3.0×10-8 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(CH3COO-)
B.常温下,已知酸H2A存在如下平衡:H2A 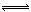 H+ + HA-;HA-
H+ + HA-;HA-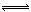 H+ + A2- (Ka15.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H+ + A2- (Ka15.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al + 3Ag2S =" 6Ag" + Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是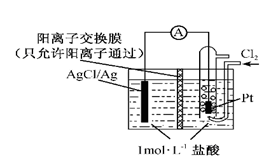
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是
| A.电池反应中有NaCl生成 |
| B.电池的总反应是金属钠还原三价铝离子 |
| C.正极反应为:NiCl2+2e-=Ni+2Cl- |
| D.钠离子通过钠离子导体在两电极间移动 |
下列有关说法正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是
| A.放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH- |
| B.电池的电解液可为KOH溶液 |
| C.充电时负极反应为:MH+OH-→+H2O+M+e- |
| D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |