【改编】【2014嘉兴二模卷改编】(15分)汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1
4NO(g)+CO2(g)+2H2O(g) △H1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2
2N2(g)+CO2(g)+2H2O(g) △H2
③CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H1、△H2、△H3三者关系式为 。
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) : n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) : n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的5L容器中,10分钟达到平衡,则NO2的化学反应速率为 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
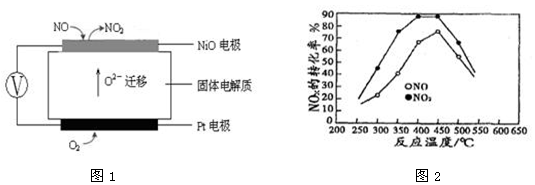
①NiO电极上NO发生的电极反应式 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中n(NO)︰n(NO2)= 。
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是 。
结论一:相同温度下NO转化效率比NO2的低。
结论二:在250℃—450℃时,NOx转化率随温度升高而增大,450℃—600℃时NOx转化率随温度升高而减小。
结论二的原因是 。
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂
B.降低温度
C.分离出H2O(g)
D.增大压强
E.增加原催化剂的表面积
F.减小投料比[n(NO2) : n(CH4)]
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。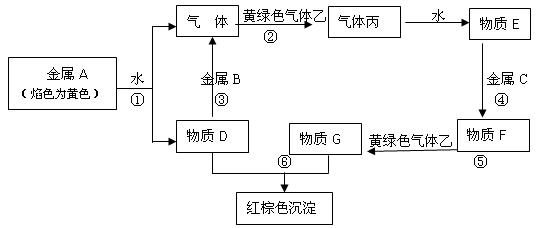
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A、B、C、
F、 H、乙
(2)写出下列反应化学方程式:
反应①
反应⑤
反应⑥
氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出
①(CN)2与KOH溶液反应的化学方程式:
_________________________________________________________________;
②在NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式:
_____________________________________________________________________。
甲、乙两相邻的化工厂,排放的污水经处理后,仍然各溶有以下八种离子(Ag+、Fe3+、Ba2+、Na+、Cl-、SO42-、NO3-、OH-)中各不相同的 4种,若单独排放,则造成环境污染,如果将甲、乙两厂的污水按适当比例充分混合,再经沉淀后,排放的污水转变为无色澄清的NaNO3溶液,污染程度大为降低,又经测定,甲厂污水的pH大于7,试推断:
(l)甲厂污水中含有的4种离子是;
(2)乙厂污水中含有的4种离子是.
防治碘缺乏病的碘添加剂是KIO3(如加碘盐),可用盐酸酸化的KI淀粉混合液检验食盐是否加碘,其反应的离子方程式为:
通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为:
,
不能用NaOH溶液的原因是,
也不能用NaCO3的原因是(用离子方程式表示原因)