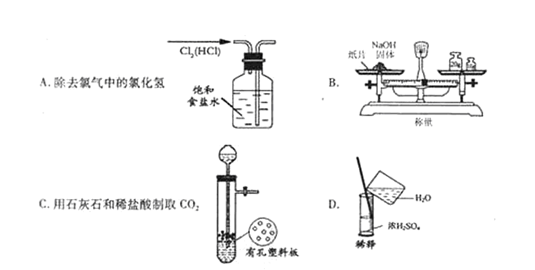
下列有关实验的操作、原理和现象的叙述正确的是
| A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| C.为观察Mg条在CO2中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚夹持点燃后迅速投入上述集气瓶底部 |
| D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 |
XSO4溶液与NaOH溶液反应,可生成X3(OH)4SO4沉淀和Na2SO4溶液,现有V1mL0.1mol/L XSO4溶液和V2mL 0.2mol/L NaOH溶液(V1+V2=50),为了使沉淀的质量达到最大值,V1和V2的取值应为( )
| A.V1=30,V2=20 | B.V1=20,V2="30" | C.V1=10,V2="40" | D.V1=15,V2=35 |
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、或Ni)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图。关于此转化过程的叙述不正确的是 ( )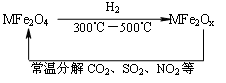
| A.MFe2O4在与H2反应中表现了氧化性 |
| B.若4mol MFe2Ox与1mol SO2恰好完全反应则MFe2Ox中x的值为3.5 |
| C.MFe2Ox与SO2反应中MFe2Ox被还原 |
| D.MFe2O4与MFe2Ox中金属元素化合价改变 |
向含0.78molFeCl2溶液中通入0.09molCl2, 再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为 ( )
| A.+3 | B.+2 | C.+1 | D.+5 |
用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为( )
| A.量筒 | B.容量瓶 | C.滴定管 | D.以上均不对 |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )