①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②=③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>②>① |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V3>V2=V1 | D.V1=V2>V3 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.将NO2和N2O4分子共NA的混合气,气温降至标况下,其体积为22.4L |
| B.7.8gNa2O2与足量水充分反应转移电子数为0.1NA |
| C.同温同压下,体积均为11.2L的CO2和SO2所含有氧原子数为NA |
| D.新戊烷与异戊烷的混合物7.2g中所含共价键为1.6NA |
我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如图所示,下列有关说法正确的是()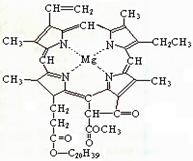
| A.叶绿素属于高分子化合物 |
| B.叶绿素分子中含有两种类型的双键 |
| C.叶绿素不属于芳香烃 |
| D.在一定条件下,叶绿素能加成、水解、酯化等反应 |
同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为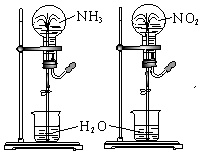
| A.①>② | B.①<② |
| C.①=② | D.不能确定 |
下列说法正确的是:
| A.极性分子可能是离子化合物,也可能是共价化合物。 |
| B.晶体中只要有阳离子,就一定有阴离子,只要有阴离子,也一定有阳离子 |
| C.在熔化状态和水溶液中均不能导电的物质称为非电解质 |
| D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |