(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl 溶液
②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液
④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl ⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中
c(NH4+) c(Cl-)(选填“ >”“=”“<”)。
已知某有机物的结构简式为:CH2=CH2
(1)该有机物中所含官能团的名称是;
(2)该有机物发生加聚反应后,所得产物的结构简式为_;
(3)写出该有机物与溴的CCl4溶液反应的化学方程式:。
有下列六组物质:属于同系物的是,属于同分异构体是,属于同种物质的是。(填序号)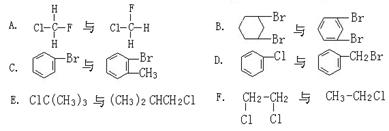
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。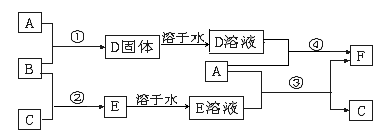
请回答:
(1)写出B物质的化学式:;F的名称:。
(2)写出第③步反应的化学方程式为。
(3)第④步反应中溶液颜色的变化;
(4)F溶液中滴入NaOH溶液可能产生的实验现象是。
下图是各物质的反应关系图:已知A和E都是黄色粉末.F有刺激性气味且有漂白性常被不法商人用来漂白腐竹等.请据此回答下列问题:
(1) 写出下列各物质的化学式: A.__________ E_________
(2)写出图中编号的化学方程式:
①_______________________②_________________________
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为。
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。
(3)陶瓷、玻璃、水泥的组成中的共同成分是______________。