25 ℃时,某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
下列离子方程式中正确的是
| A.在酸性硫酸亚铁溶液中加入过氧化氢:Fe2++H2O2+2H+=Fe3++2H2O |
| B.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
| C.在含有Mn2+的溶液中加入HNO3,再加入PbO2,则反应体系显紫红色: 5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2HO |
| D.将数滴0.1 mol/L 盐酸溶液缓缓滴入1 mol/L 50mL Na2CO3溶液中,且不断搅拌: |
2H++CO32-=CO2↑+H2O
肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为:N2H4+O2 N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
A.负极的电极反应式是:N2H4+4OH--4e- 4H2O+N2↑ 4H2O+N2↑ |
B.正极的电极反应式是:O2+4H++4e- 2H2O 2H2O |
| C.溶液中阴离子向正极移动 |
| D.溶液中阴离子物质的量浓度基本不变 |
化合物A为一种盐,元素分析表明,A中部分元素的质量分数为:Cu39.50%、N8.64%,其余为H、O、S。A与NaOH混合时有能使湿润的红色石蕊试纸变蓝的气体产生,则A的化学式为
| A.CuNH4SO3 | B.Cu(NH4)2(SO4)2 | C.Cu3(NH4)2(SO4)3 | D.Cu(NH4)2(S2O3)2 |
下列对实验现象的解释与结论正确的是
A.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有白色沉淀产生,说明蛋白质发生了变性
B.向某溶液中加入Ba(NO3)2溶液,有白色沉淀产生,说明该溶液中一定含有SO42-
C.向甲苯中滴入少量浓溴水,振荡,静置,溶液分层,上层呈橙红色,下层几乎无色,说明甲苯和溴水发生取代反应,使溴水褪色
D.向蔗糖中加入浓硫酸,变黑,放热,体积膨胀,放出刺激性气体,说明浓硫酸具有脱水性和强氧化性,反应中可能生成C、SO2和CO2等物质
设NA代表阿伏加德罗常数,下列说法正确的是
| A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B.常温下含有NA个NO2、N2O4分子的混合气,温度降至标准状况,其体积约为22.4L |
C.10g钾所含的电子数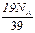 |
| D.0.1mol 24Mg32S晶体中所含中子总数为2.8NA |