铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq)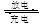 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时覆盖PbO2的电极为正极,发生还原反应 |
| B.放电时电解质溶液中的H+向正极移动 |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.充电时电解质溶液的pH逐渐增大 |
下列说法正确的是
A.水的电离方程式:H2O H++OH- H++OH- |
| B.升高温度,水的电离程度增大 |
| C.在NaOH溶液中没有H+,在HCl溶液中没有OH- |
| D.纯水中c(H+)=10-7 mol·L-1 |
糖类、油脂、蛋白质为基本营养物质。下列有关说法正确的是
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.糖类的主要成分是高级脂肪酸甘油酯
D.油脂、蛋白质都能发生水解反应
今有五种有机物:
①CH2OH(CHOH)4CHO②CH3(CH2)3OH
③CH2===CH—CH2OH ④CH2===CH—COOCH3
⑤CH2===CH—COOH
其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是
| A.③⑤ | B.①②⑤ | C.②④ | D.③④ |
下列关于常见有机物的说法中,不正确的是
| A.苯和乙烯都能与氢气发生加成反应 |
| B.乙酸和乙醇都能与氢氧化钠发生加成反应 |
| C.淀粉和蛋白质都是人体重要的营养物质 |
| D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
通过核磁共振氢谱可以推知(CH3)2CHCH2CH2OH有多少种化学环境的氢原子
| A.6 | B.5 | C.4 | D.3 |