如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间。假设在电解过程中产生的气体全部逸出,下列说法正确的是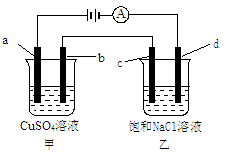
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a电极反应式为:4OH――4e-===O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) |
某化学科研小组研究在其他条件不变时,改变其一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是()
A.反应Ⅰ:△H>0,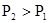 |
B.反应Ⅱ:△H>0, |
| C.反应Ⅲ:△H>0 | D.反应Ⅳ:△H<0, |
下列有关电化学的装置完全正确的是()
已知:NaA水溶液呈碱性,常温下将0.10molNaA和0.05molHCl溶于水,得到PH<7的溶液,则溶液中离子浓度关系正确的是()
A.c(A-)+c(OH-)=c(Na+)+c(H+) B.c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(HA)+c(A-)=2c(Na+) D.c(Na+)>c(Cl-)>c(A-)>c(H+)
下列有关反应热的叙述正确的是()
| A.已知2H2(g)+O2(g) |
| B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 |
C.X(g)+Y(g) Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X, Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大 |
| D.已知C(s)+O2(g)=CO2(g)△H1 , C(s)+1/2O2(g)=CO(g)△H2, |
则△H1<△H2
下列各溶液中微粒的物质的量浓度关系错误的是()
A.0.2mol/L K2CO3溶液中c(OH-)=c(HCO-3)+c(H+)+2c(H2CO3)
B.0.1mol/L NaHA溶液中其中pH=3,c(HA-)>c(H+)>c(H2A)>c(A2-)
C.向Na2SO4溶液中滴加稀CH3COOH得到pH=4的混合溶液c(Na+)=2c(SO2-4)
D.pH=a的HA溶液与pH=b的MOH溶液任意比混合c(H+)+c(M+)=c(OH-)+c(A-)