下列说法中错误的是
| A.键长越长,化学键越牢固 |
| B.成键原子间原子轨道重叠越多,共价键越牢固 |
| C.对双原子分子来讲,键能越大,含有该键的分子越稳定 |
| D.原子间通过共用电子对所形成的化学键叫共价键 |
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH溶液的体积为1L),则下列判断不正确的是 ( )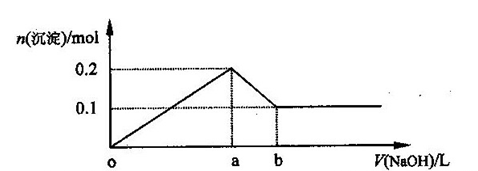
| A.NaOH的浓度为0.6 mol/L | B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 | D.图中线段oa : ab=5 : 1 |
下图是产生和收集气体的实验装置,该装置最适合于
| A.用浓硝酸与Cu反应制取NO2 |
| B.用浓盐酸和MnO2反应制取C12 |
| C.用NH4Cl和Ca(OH)2反应制取NH3 |
| D.用H2O2溶液和MnO2反应制取O2 |
以下物质间的每步转化通过一步反应能实现的是( )
| A.Al→Al2O3→Al(OH)3→NaAlO2 | B.Si→SiO2→H2SiO3→Na2SiO3 |
| C.S→SO3→H2SO4→MgSO4 | D.N2→NO→NO2→HNO3 |
盛有BaCl2稀溶 液的甲、乙两支试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
液的甲、乙两支试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲、乙两试管都有白色沉淀生成 |
B.甲试管无白色沉淀生成,而乙试管有白色沉淀生成 |
C.甲、乙两试管都无白色沉淀生成 |
D.甲试管有白色沉淀生成,而乙试管无白色沉淀生成 |
将100gK2CO3和KHCO3的混合物加热至质量不再变化时,共收集到CO211g,原混合物中KHCO3的质量分数是()
| A.30% | B.40% | C.50% | D.60% |