下列离子方程式书写正确的是
A.酸性高锰酸钾与少量双氧水反应:2MnO +7H2O2+6H+= 2Mn2++6O2↑+10H2O +7H2O2+6H+= 2Mn2++6O2↑+10H2O |
B.用石墨电极电解饱和MgCl2溶液:2Cl-+ 2H2O 2OH-+ Cl2↑+ H2↑ 2OH-+ Cl2↑+ H2↑ |
| C.Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++ HCO3-+OH—=MgCO3↓+H2O |
| D.向NaClO溶液中通入过量CO2;CO2+ClO—+H2O=HCO3-+HClO |
钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是: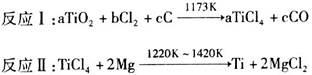
关于反应I、Ⅱ的下列说法中正确的是
| A.反应I中的TiO2是氧化剂 |
| B.TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂 |
| C.a=b=c=2 |
| D.每生成9.6 g Ti,反应I、Ⅱ中共转移0.8 mol电子 |
下列有关说法不正确的是
| A.为防止水污染,可用O3替代Cl2作饮用水消毒剂 |
| B.实验室可用浓硫酸干燥SO2气体 |
| C.16O和18O能形成三种化学性质相同的氧分子 |
| D.Al2(SO4)3,可除去碱性废水及酸性废水中的悬浮颗粒 |
下列单质或化合物性质的描述正确的是
| A.Na2CO3的溶解性比NaHCO3小 |
| B.SiO2与酸、碱均能反应,属于两性氧化物 |
| C.FeCl3溶液制作铜质印刷线路板的离子反应为2Fe3++Cu=2Fe2++Cu2+ |
| D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
化学在生产和生活中有着广泛的应用。下列说法错误的是
| A.二氧化硫在食品加工中可用作食品增白剂 |
| B.航天飞机上的隔热陶瓷瓦属于复合材料 |
| C.用活性炭做净化剂除去冰箱中异味 |
| D.含H2SO4的废水用BaCl2处理后不可直接排放 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |