某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:
下列说法正确的是
| A.沉淀甲可能是AgBr |
| B.沉淀丙一定是BaCO3 |
| C.气体甲的成份只有4种可能 |
| D.肯定存在的离子有AlO2-、S2-、SO32-、Na+ |
1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气
| A.5mol | B.4mol | C.1mol | D.6mol |
在盛有稀H2SO4的烧杯中插入用导线连接的锌片和铜片,下列叙述正确的是
| A.正极附近的SO4 2- 离子浓度逐渐增大 | B.铜片上有H2逸出 |
| C.溶液的pH逐渐变小 | D.电子通过导线由铜片流向锌片 |
在锌粒与盐酸反应中,改变下列条件不能加快反应速率的是
| A.升高反应温度 | B.增大盐酸的浓度 |
| C.将小锌粒换成大锌粒 | D.在盐酸中滴入几滴CuSO4溶液 |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
| A.乙烯的结构简式:CH2CH2 | B.乙醇的结构式:CH3CH2OH |
C.四氯化碳的电子式: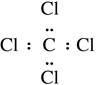 |
D.甲烷分子的比例模型 |
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制得产物,即原子利用率100%。以下反应最符合绿色化学的是
| A.CH2=CH2与HCl反应制取CH3CH2Cl | B.CH4与Cl2反应制取CCl4 |
| C.苯与液溴反应制取溴苯 | D.乙醇与金属钠反应制取乙醇钠 |