如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是
| A |
|
C |
| |
B |
|
A.B在第三周期ⅦA族
B.C元素单质是氧化性最强的非金属单质
C.A与C的气态氢化物相比,稳定性与溶液的pH:A<C
D.最高价氧化物对应的水化物的酸性:C>B
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是()
| A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2 |
| B.放电时,正极区溶液的pH减小 |
| C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D.充电时,电池的锌电极接电源的正极 |
下列关于电解质溶液的叙述正确的是 ()
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) |
| B.在0.1mol·L-1的NaHA溶液pH=4,则H2A为强酸 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 |
| D.向0.1mol·L-1的氨水中加少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是()
| A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多 |
| B.盐酸和醋酸都可用相应的钠盐和浓硫酸反应制取 |
| C.室温下,0.1mol·L-1醋酸钠溶液的pH>7,氯化钠溶液pH=7 |
| D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
对于可逆反应A(g)+2B(g)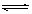 2C(g) ΔH﹥0,下列图象中正确的是()
2C(g) ΔH﹥0,下列图象中正确的是()
下列有关反应限度的叙述正确的是()
| A.大多数化学反应在一定条件下都有一定的限度 |
| B.依据焓判据:NH4HCO3受热分解可自发进行 |
| C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 |