(12分)【化学——物质结构与性质】硼在半导体工业中被大量用作半导体掺杂物,同时含硼化合物在杀虫剂、防腐剂及新型储氢材料的制造中也有重要的地位。请回答下列问题:
(1)在第2周期的元素中,基态原子的第一电离能小于硼的元素有_________种。
(2)硼砂是人们最早使用的含硼化合物之一,其阴离子Xm-( Xm-中只含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型分别为_____、_____;图中标注为2号的原子与相邻原子成键形成的键角_____4号原子与相邻原子成键形成的键角(填“大于”“小于”或“等于”)。在下列各项中,在Xm-内不存在的化学键是____(填下列序号字母)。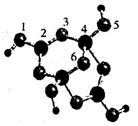
a.离子键 b.共价键 c.配位键
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料。镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=____。氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作______(填下列序号字母)。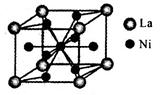
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头
(1)按要求填空
①KOH的电子式:
②C(CH3)4的系统命名:
(12分)一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
(1)该反应的化学方程式是。
(2)在图上所示的三个时刻中,(填“t1”“t2”或“t3”)时刻处于平衡状态,此时v正v逆(填“>”“<”或“=”);0- t2时间段内v(N) =。
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再改变”(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是(选填字母)。
| A.升高温度 | B.降低压强 |
| C.减小M的浓度 | D.将反应容器体积缩小 |
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:,形成的晶体是晶体。
高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=,△H 0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是
A.减少Fe的量
B.增加Fe203的量
C.移出部分C02
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
(1)以CO2为碳源制取低碳有机物成为国际研究焦点,下面CO2加氢制取低碳醇的热化学方程式:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJ•mol﹣1
则2CH3OH(g)=CH3CH2OH(g)+H2O(g) 的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式
(3)在一定温度下,有c(H+)相同盐酸、硫酸、醋酸三种酸,物质的量浓度分别为c1、c2、c3,则三者由大到小的顺序是
(4)对于A+2B(g)⇌nC(g)在一定条件下达到平衡后,增大压强,平衡不移动,若n=2,A的状态为;若A为固体,增大压强,C的组分含量减少,则n